Menurut (Brady, 1999) dalam kehidupan sehari-hari di laboratorium biasanya menggunakan larutan yang lebih rendah konsentrasinya dengan cara menambah pelarutnya misalnya banyak laboratorium kimia membeli larutan senyawa kimia dalam air yang konsentrasinya pekat. Biasanya larutan kimia yang dibeli ini demikian pekatnya sehingga larutan harus diencerkan. Proses pengenceran adalah mencampur larutan pekat (konsentrasi tinggi) dengan cara menambah pelarut agar diperoleh volume yang lebih besar.
| Reagen | molaritas |
| Asam Sulfat (H2SO4) | 18 |
| Asam Klorida (HCl) | 12 |
| Asam fosfat (H3PO4) | 5 |
| Asam Nitrat (HNO3) | 16 |
| Asam asetat (HC2H3O2) | 17.5 |
| Larutan amonium dalam air (NH3) | 15 |
(Brady, 1999)
Melalui proses ini mol solut tetap konstan dan hanya volumenya yang bertambah. Hal ini menunjukkan masalah yang dihadapi dalam pekerjaan yang berkaitan dengan pengenceran jika dikalikan molaritas larutan M dengan volume V didapatkan jumlah mol dari solute.
Menurut (Rosenberg, 1996) Jika larutan diencerkan, volumenya bertambah besar dan konsentrasinya bertambah kecil, tetapi kuantitas total zat terlarut tidak berubah. Jadi dua buah larutan yang konsentrasinya berbeda tetapi mengandung zat terlarut yang kuantitasnya sama, mempunyai hubungan sebagai berikut:
V1 . M1 = V2 . M2
V1 = volume larutan awal yang dipakai
M2= Molaritas awal
V1= volume larutan standar yang akan dibuat
M2= molaritas akhir
Menurut (Brady, 1999) jika suatu larutan senyawa kimia yang pekat diencerkan kadang-kadang sejumlah panas dilepaskan. Hal ini terutama dapat terjadi pada pengenceran asam sulfat pekat. Agar panas ini dapat dihilangkan dengan aman, asam sulfat pekat yang harus ditambahkan ke dalam air, tidak boleh sebaliknya.
Contoh
Menurut (Zulfikar, 2010) Untuk pengenceran, misalnya 50 mL larutan CuSO4 dengan konsentrasi 2 M, diubah konsentrasinya menjadi 0.5 M. Dalam benak kita tentunya dengan mudah kita katakan tambahkan pelarutnya, namun berapa banyak yang harus ditambahkan. Perubahan konsentrasi dari 2 M menjadi 0.5 M, sama dengan pengenceran 4 kali, yang berarti volume larutan menjadi 4 kali lebih besar dari 50 mL menjadi 200 mL. Berapakah nilai V2? Secara sederhana kita dapat selesaikan secara matematis :
Labu Ukur

Menurut (Agustina, 2011) Labu ukur dipakai untuk membuat larutan standar dengan volume tertentu misalnya 10, 25, 50 mL. Jangan digunakan beaker glass untuk membuat larutan standar sebab labu ukur lebih presisi.
Menurut (Agustina, 2011) Labu Ukur adalah sebuah perangkat yang memiliki kapasitas antara 5 mL sampai 5 L dan biasanya instrumen ini digunakan untuk mengencerkan zat tertentu hingga batas leher labu ukur. Alat ini biasanya digunakan untuk mendapatkan larutan zat tertentu yang nantinya hanya digunakan dalam ukuran yang terbatas hanya sebagai sampel dengan menggunakan pipet. Dalam sistem pengenceran, untuk zat yang tidak berwarna, penambahan aquadest sampai menunjukkan garis meniskus berada di leher labu. Untuk zat yang berwarna, penambahan aquadets hingga dasar meniskus yang menyentuh leher labu ( meniskus berada di atas garis leher ). Sebelum menggunakan instrumen ini, labu ukur harus dicuci terlebih dahulu. Lebih baik menggunakan sabun agar zat – zat yang tidak dibutuhkan dapat terlarut dan akhirnya terbuang. Dalam keadaan bagaimanapun, labu ukur yang kering sangatlah baik untuk digunakan.
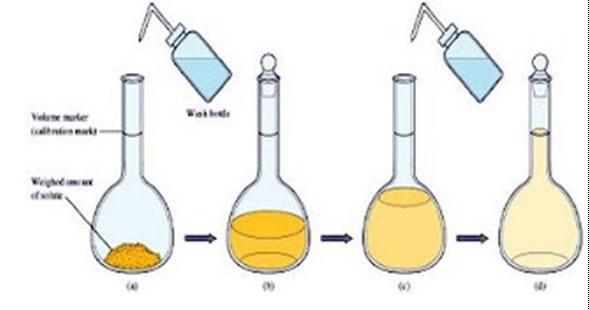
- Zat terlarut dimasukkan dalam sebuah labu volumetri ( labu ukur )
- Ditambahkan air suling (aquades)
- Campuran digojog untuk melarutkan zat terlarut
- Setelah ditambahkan aquades lagi, digunakan pipet tetes untuk menambahkan air dengan hati – hati sampai volume permukaan cairan tepat berimpit dengan tanda lingkaran pada leher labu.
- Labu disumbat dan kemudian digojog agar larutan homogen.
Daftar Pustaka
Agustina, Rina. 2011. “Teknik Laboratorium Asyik”. http://biologi-rani.blogspot.com/2011/11/teknik-laboratorium-asyik.html. diakses pada 13 Juli 2012 pada pukul 19.17 WIB.
Brady, James. 1999. Kimia Universitas Asas dan Struktur. Jakarta : Binarupa Aksara
Rosenberg, Jerome. 1996. Kimia Dasar. Jakarta: Rineka Cipta
Zulfikar. 2010. “Pengenceran”. http://www.chem-is-try.org/materi_kimia/kimia-kesehatan/larutan/pengenceran/. diakses 13 Juni 2012 pada pukul 19.05 WIB.
